
第 1 页 / 共 19 页
答案陈钟秀_第1页_学霸英雄_www.xuebayingxiong.com.png)
第 2 页 / 共 19 页
答案陈钟秀_第2页_学霸英雄_www.xuebayingxiong.com.png)
第 3 页 / 共 19 页
课后答案完整版-朱自强_第1页_学霸英雄_www.xuebayingxiong.com.png)
第 4 页 / 共 19 页
课后答案完整版-朱自强_第2页_学霸英雄_www.xuebayingxiong.com.png)
第 5 页 / 共 19 页

第 6 页 / 共 19 页

第 7 页 / 共 19 页

第 8 页 / 共 19 页

第 9 页 / 共 19 页

第 10 页 / 共 19 页

第 11 页 / 共 19 页

第 12 页 / 共 19 页

第 13 页 / 共 19 页

第 14 页 / 共 19 页

第 15 页 / 共 19 页

第 16 页 / 共 19 页

第 17 页 / 共 19 页
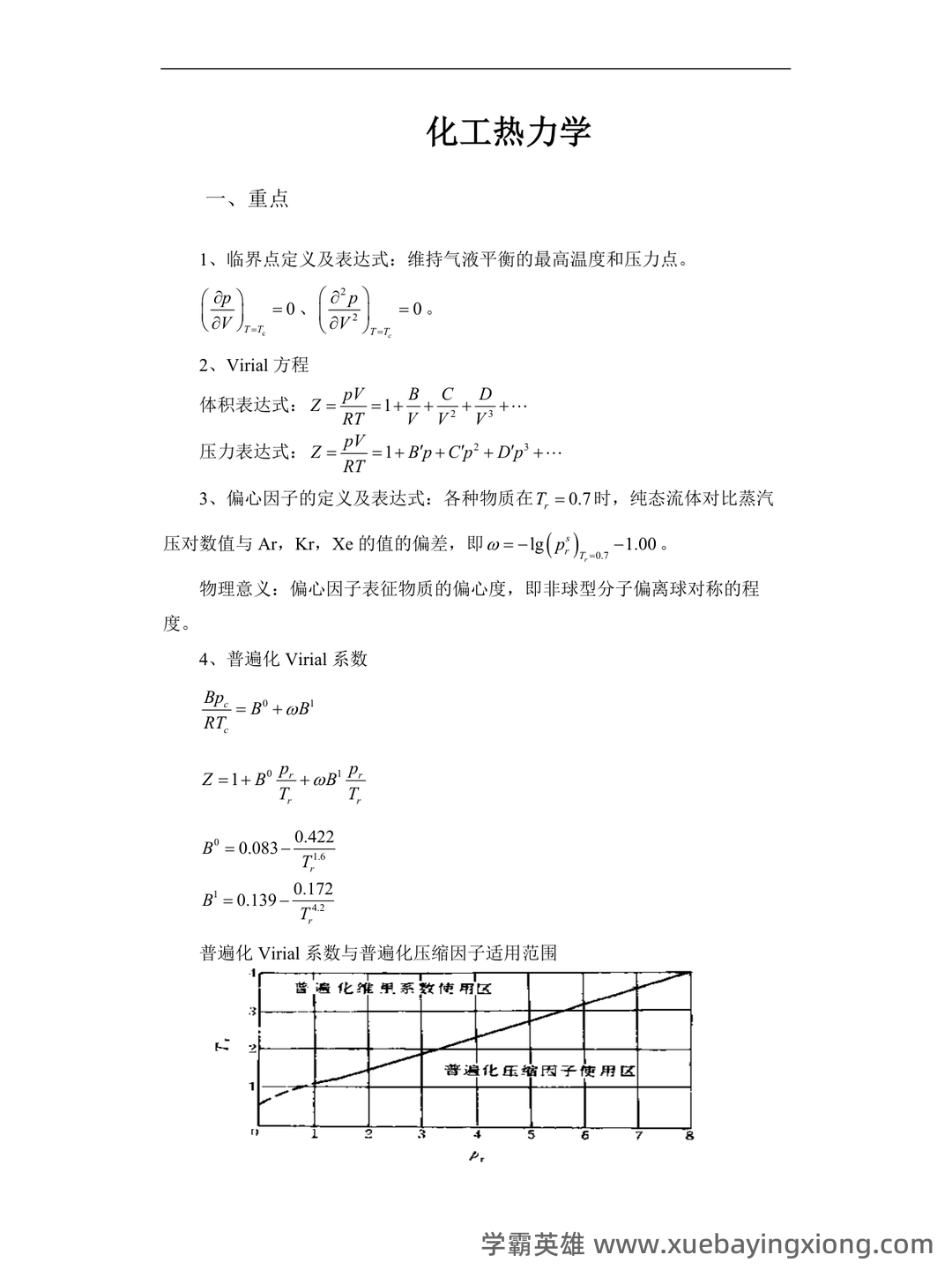
第 18 页 / 共 19 页

第 19 页 / 共 19 页
化工热力学的名词解释
化工热力学的名词解释 化工热力学,简单来说,就是利用热力学原理来分析和设计化学反应和过程。它不像传统物理学那样关注单个的物体的运动,而是更侧重于化学体系的能量变化,即热力学性质的变化。 记住“化工热力学”这个词,它本身就预示着这门学科的独特之处——它不是纯粹的理论,而是直接服务于化工生产的。 首先,我们要了解一些关键概念。比如“焓”(Enthalpy),它是衡量系统内总能量的一个指标,包含内能和压力乘以体积。在化工热力学中,焓的变化(ΔH)是评估反应是否自发的重要依据。正ΔH表示吸热反应,负ΔH表示放热反应。 再来看看“熵”(Entropy)。熵是衡量系统无序程度的指标。在热力学平衡状态下,系统总是朝着熵增的方向发展。理解熵对于判断反应的平衡常数至关重要。 “吉布斯自由能”(Gibbs Free Energy)是热力学预测反应自发性最常用的工具。它结合了焓和熵的信息,能够更准确地预测反应在一定温度和压力下是否自发进行。 记住,吉布斯自由能的变化(ΔG)等于ΔH减去TΔS,其中T是绝对温度,ΔS是熵变。 此外,“热力学平衡”也至关重要。它指的是系统在满足特定条件下的稳定状态,在这个状态下,系统的内能不变。 掌握这些基础名词,才能更好地理解化工热力学所要解决的问题:如何优化反应条件,提高产品产率,降低生产成本,最终实现高效、可持续的化工生产。
展开
化工热力学
2025-07-12
14次阅读