
第 1 页 / 共 19 页
答案陈钟秀_第1页_学霸英雄_www.xuebayingxiong.com.png)
第 2 页 / 共 19 页
答案陈钟秀_第2页_学霸英雄_www.xuebayingxiong.com.png)
第 3 页 / 共 19 页
课后答案完整版-朱自强_第1页_学霸英雄_www.xuebayingxiong.com.png)
第 4 页 / 共 19 页
课后答案完整版-朱自强_第2页_学霸英雄_www.xuebayingxiong.com.png)
第 5 页 / 共 19 页

第 6 页 / 共 19 页

第 7 页 / 共 19 页

第 8 页 / 共 19 页

第 9 页 / 共 19 页

第 10 页 / 共 19 页

第 11 页 / 共 19 页

第 12 页 / 共 19 页

第 13 页 / 共 19 页

第 14 页 / 共 19 页

第 15 页 / 共 19 页

第 16 页 / 共 19 页

第 17 页 / 共 19 页
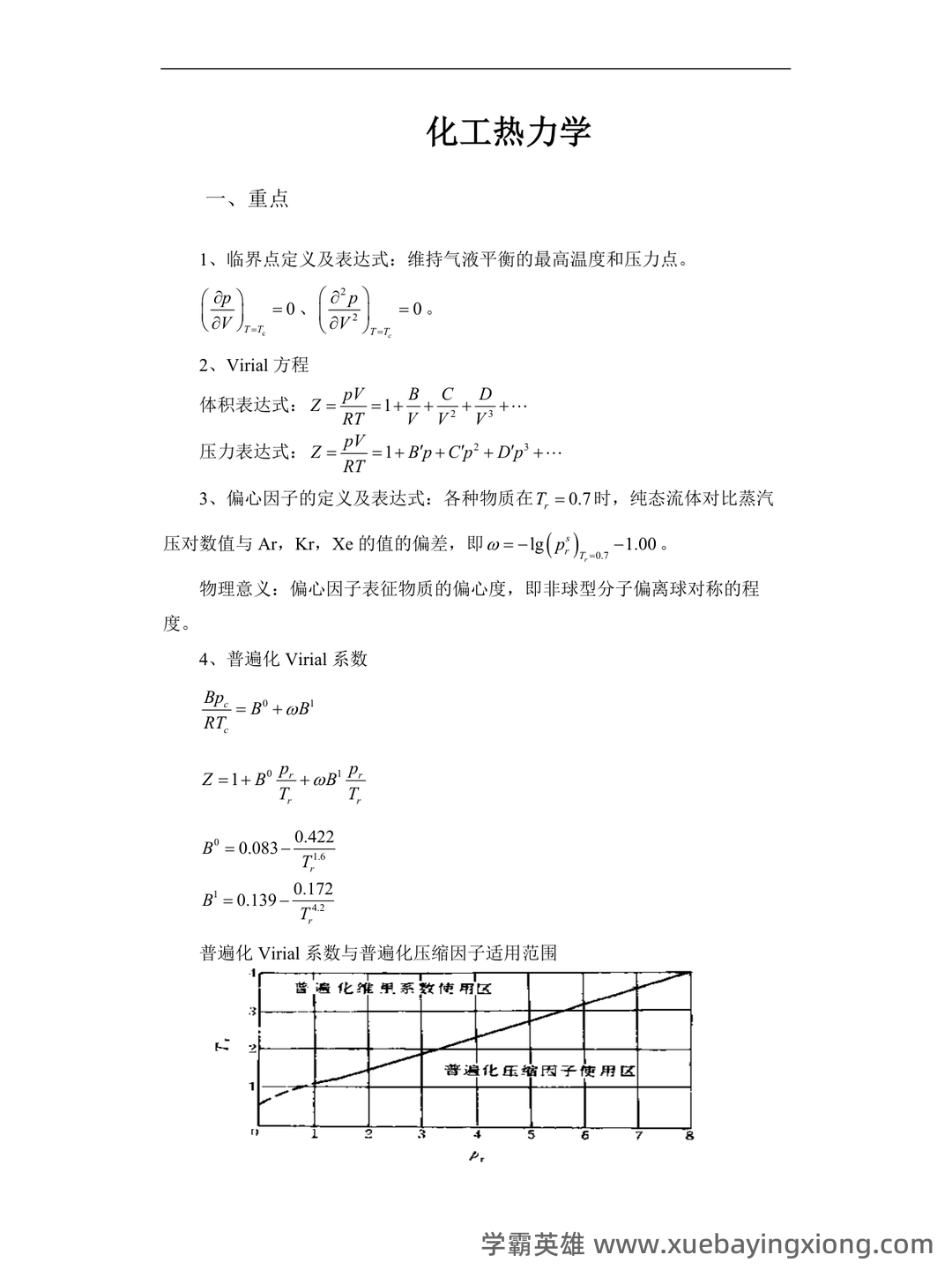
第 18 页 / 共 19 页

第 19 页 / 共 19 页
化工热力学重点复习资料
化工热力学重点复习资料 对于化工热力学,总感觉它就像一个充满玄机的迷宫,但只要掌握住关键点,就能从中找到突破口。它不仅仅是公式的堆砌,更是一门与能量、物质的本质联系在一起的学科。理解好热力学第一定律和第二定律,就如同掌握了化工过程能量守恒的基石。 热力学第一定律,简单来说,就是能量既不能凭空产生也不能凭空消失,只能从一种形式转化为另一种形式。在化工过程中,这通常体现在热量传递(传热)、功传递和化学反应的能量变化上。记住,每一步都要关注能量的流动和转化。 然而,更要警惕第二定律,它告诉我们,任何自然过程都伴随着熵增,即能量的品质降低。这意味着我们不能完全得到能量的再利用,任何能量转化都不可避免地伴随着损失。理解熵增对于预测反应的自发性以及优化化工工艺至关重要。 接下来,回顾一下常用的热力学状态函数:内能(U)、焓(H)、熵(S)和깁스自由能(G)。它们分别描述了系统在不同条件下所具有的能量和状态信息。尤其要注意焓的定义:H = U + pV, 它在计算化学反应的热量变化时扮演着核心角色。 此外,热力学平衡常数(K)也值得重点复习。它描述了在特定条件下反应物和产物的浓度关系,对于预测反应的收率和优化反应条件具有重要意义。 搜索词条“化工热力学复习资料”应该会提供更多相关计算方法和案例分析,务必认真研读。
展开
化工热力学
2025-07-12
17次阅读